ANÁLISE QUÍMICA DE FOSFITO
Arnaldo A. Rodella
Fosfito é nome genérico que se
dá aos sais do ácido fosforoso H3PO3.
Este ácido é conhecido na química por uma característica interessante: um dos
átomos de hidrogênio de sua molécula não tem função de ácido.

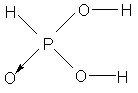
Ácido Fosfórico Ácido Fosforoso
No ácido fosfórico H3PO4, por exemplo, os 3 átomos de
hidrogênio atuam como ácido, muito embora a ionização do terceiro hidrogênio
seja muito pequena:
H3PO4 ↔ H2PO4-
+ H+ Ka1 = 7,11 10-3
H2PO4- ↔ HPO4-2 + H+ Ka2 = 6,32 10-8
HPO42- ↔ PO4
3- + H+ Ka3
= 7,10 10-13
No caso do ácido fosforoso o terceiro
hidrogênio não se ioniza por questão estrutural.
H3PO3 ↔ H2PO3
- + H+ Ka1
= 3 10-2
H2PO3 - ↔ HPO32- + H+ Ka2
= 1,62 10-7
A utilização dos fosfitos na
agricultura levantou algumas dúvidas sobre seu exato papel nas plantas. Parece que
ele não pode ser considerado como fonte do nutriente fósforo às plantas, mas
sugere-se que teria um papel de agente protetor dos vegetais, como no caso de
eventuais efeitos tóxicos de defensivos.
Na comercialização do fosfito
se requer que o produto seja registrado junto ao órgão competente. A questão
que logo surgiu foi quanto a análise química dos
fosfitos para fins de fiscalização dos teores garantidos.
Uma das alternativas mais
práticas de análise química seria oxidar o ácido fosforoso à
ácido fosfórico. Isso é uma vantagem porque o íon fosfato pode ser facilmente
determinado por espectrofotometria através da formação de um composto amarelo
pela reação com íons vanadato e molibdato.
O ácido fosforoso não forma composto colorido com os sais citados. Na dúvida de
identificação entre íons fosfato e fosfito faz-se determinações de fósforo antes
e após a oxidação do produto. Uma crítica que caberia a esse procedimento é que
não se efetua uma determinação direta de fosfito.
A oxidação de fosfito apenas
com ácido nítrico não produz fosfato. O emprego de ácido nítrico e ácido
clorídrico nas proporções empregadas na determinação de fósforo total pelo
método oficial promove oxidação de grande parte do produto, mas não total.
A conversão completa pode ser
conseguida de maneira relativamente fácil com ácido sulfúrico:
H3PO3 + H2SO4 ↔ SO2 +
H2O + H3PO4
Testes efetuados mostraram que
este procedimento foi adequado para oxidar integralmente o fosfito e a
determinação espectrofotométrica do fosfato produzido pode ser efetuada sem
problemas. Deste modo, sugere-se o procedimento descrito a seguir.
Reativos
- solução padrão de fósforo a 200 mg L-1 P2O5
: pesar 0,3835g KH2PO4 seco por
2 horas a 100-110oC, transferir para balão volumétrico de 1000 mL ,
juntar 5 mL de H2SO4 concentrado e completar o volume com
água destilada.
- reativo vanadomolíbdico : dissolver 20 g
de molibdato de amônio em 200 mL de água destilada
aquecida a 80oC, deixar esfriar e reservar. Dissolver 1 g de metavanadato de amônio em 100 mL de água destilada aquecida
a 80oC, juntar 180 mL de HNO3 concentrado, deixar
resfriar e reservar. Juntar as duas soluções cuidadosamente e sob agitação,
transferir para balão volumétrico de 1000mL e completar o volume.
Procedimento
- Preparar uma curva de calibração,
transferindo: 0, 2, 4, 6, 8 e 10 mL de solução padrão de fósforo a 200 mg L-1
P2O5 para balões volumétricos
de 50 mL.
- Adicionar 10 mL do reativo vanadomolibdico, completar o volume e deixar reagir por 10
min.
- Efetuar leitura de
absorbância a 410 nm, acertando 100% transmitância
com o a solução isenta de fósforo. Relacionar as massas de 0; 0,4; 0,6; 0,8;
1,2; 1,6 e 2,0 mg P2O5 com os
respectivos valores de absorbância para se obter a equação da curva de calibração.
- Pesar massa exatamente conhecida
m1 gramas, próxima a 1 g, de amostra de fosfito,
transferir para balão volumétrico de 250 mL e completar o volume com água
destilada, homogeneizar e reservar.
- Pesar outra massa m2 gramas, próxima
a 1 g, da mesma amostra de fosfito e transferir para copo de 250 mL
- Adicionar 5 ml de H2SO4
concentrado, aquecer e manter sob ebulição controla por 30 min, conservando o
copo coberto por vidro de relógio.
- Retirar do aquecimento,
deixar resfriar, transferir para balão volumétrico de 250 mL e completar o volume
com água destilada.
- Transferir alíquotas de 1 ml
do extrato aquoso e do extrato em ácido sulfúrico para balões volumétricos de
50 mL.
- Adicionar 10 mL da solução
reativa vanadomolibdica, completar o volume,
homogeneizar e deixar reagir por 10 min.
- Efetuar leitura de
absorbância a 410 nm, acertando 100% de transmitância
com o a solução isenta de fósforo.
Calculo
Estimar as massas P1 e P2 em miligramas de P2O5 nas alíquotas de extrato aquoso
e extrato sulfúrico, respectivamente, por meio da equação de regressão obtida.
A porcentagem de P2O5
no produto comercial será calculada pela expressão:
% P2O5
= (P2 x 25/m2)-(P1 x 25/m1)